|
不同光谱对植物光合最大羧化效率和电子传递速率有极大影响欢迎关注「汉莎科技集团」微信公众号!
许多温室栽培使用补充照明来延长生长周期和提高作物产量。然而, 照明用电成本居高不下。据估计,与补充照明相关的电力成本可能占运营成本的30%(van Iersel&Gianino,2017)。随着技术的快速发展, 种植者现在可以选择发光二极管(LED)进行补光照明, 以降低与补充照明相关的高电费。 LED灯一般具有极佳的补光效率、长寿命和可控性,并能提供窄波段的光。这为种植者提供了通过改变光谱波段和强度来调节作物生理的手段。这就需要深入了解不同波段和不同强度的光对作物光合作用、生长和发育的影响。
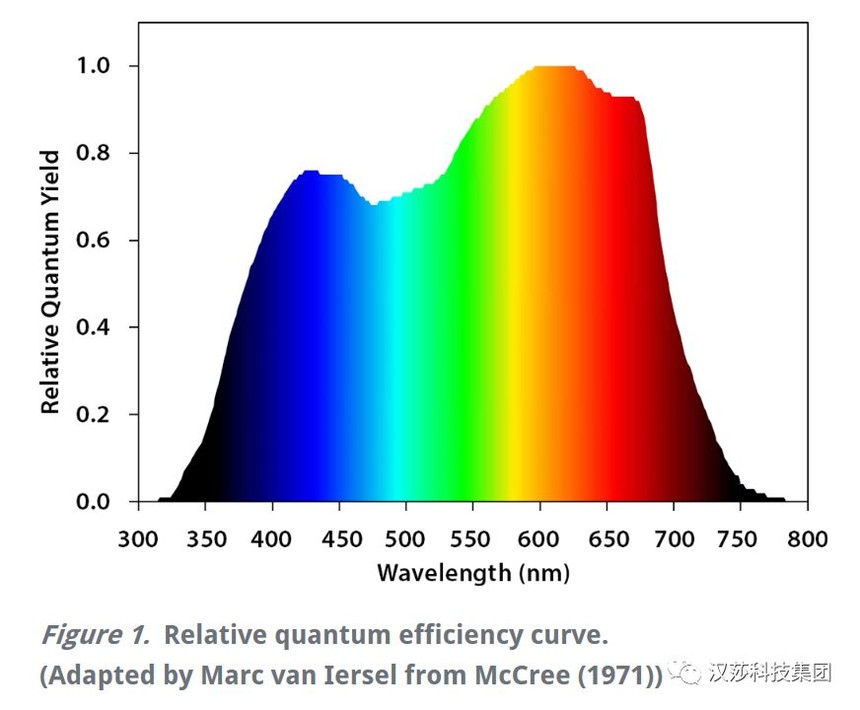
许多市售的生长灯使用红色和蓝色LED,因为它们具有很高的功效。红光和蓝光也是植物光合作用光谱吸收中的吸收峰值,在整个光谱中也是植物光合CO2固定效率禁用词汇的区段(McCree,1971)。 在红蓝光之间,红光的量子产率高于蓝光,这意味着作物可以更有效地利用红光(Mcree,1971)。然而,McCree数据的收集是在较低的光通量密度(PPFD)和单一波段下进行的,忽略了不同波段光量子之间潜在的相互影响。
有令人信服的证据表明,在较高的光子通量密度(PPFD)下,绿光的功效可能高于红光(Terashima et al., 2009),而远红光如果与较短的光波长结合使用, 会协同增加光合作用(Zhen and van Iersel, 2017)。 不同光谱对作物生长发育的影响不仅限于光合生理,还可能以作物特有的方式影响作物形态和二次代谢(Ouzounis et al.,2015)。光谱和作物特异效应的生理原因目前尚不清楚。
美国乔治亚大学园艺生理学实验室(UGA Horticulture Physiology Lab)Marc van Iersel博士为了探索红蓝光反应的生理机制,构建了快速A/Ci响应曲线,来量化生菜植株在红蓝光两种LED光照下的光合特性。 传统方法测定A/Ci响应曲线需使植物处于一个稳定的光强和CO2浓度下,直到该植物达到一个稳定的生理状态,然后再改变CO2浓度进行下一梯度的测定。 这种方法有几个缺点:
通过美国PP SYSTEMS公司CIRAS-3便携式光合/荧光测定系统禁用词汇的快速A/Ci响应技术(RACiR)对气体交换进行非稳态测量来解决这些限制,这大大加快了A/Ci响应曲线的测定进程(Stinziano et al., 2017)。RACiR技术可快速调节叶室中的CO2浓度且保持极高的控制精度,从而可以在数分钟内完成一条完整A/Ci响应曲线的测定。
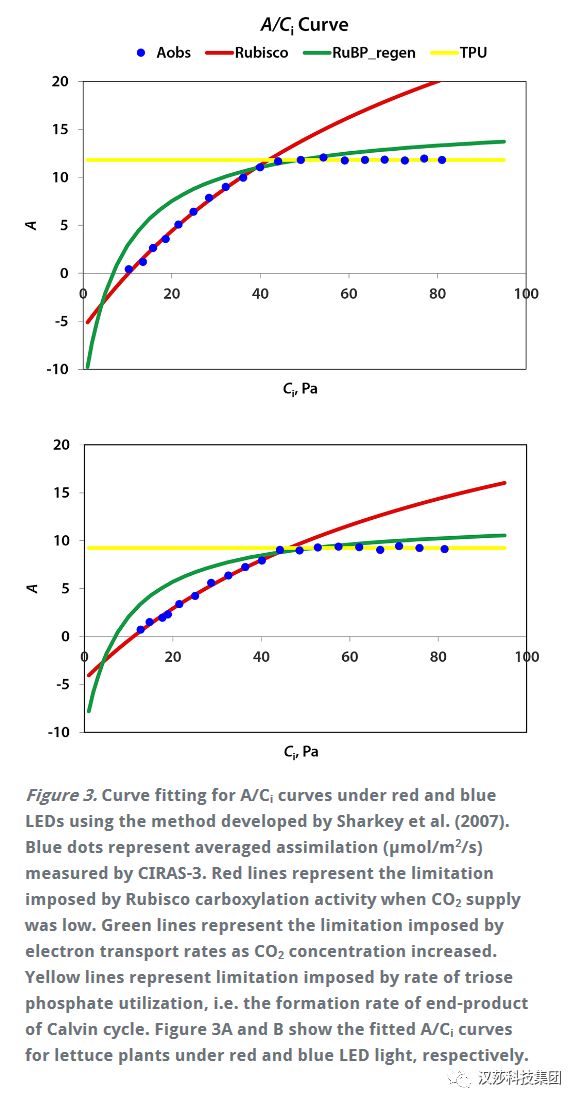
美国乔治亚大学园艺生理学实验室使用CIRAS-3便携式光合/荧光测定系统对生菜进行测定,在饱和光通量(1,000 undefinedmicro;mol/m2/s)的红光和蓝光下分别构建了A/Ci响应曲线。虽然生菜叶片对红光和蓝光的吸收能力不同,但使用饱和的PPFDs可以保证这种吸收能力的差异不会影响结果。 每条A/Ci响应曲线记录了150个光合数据,叶室中CO2浓度控制范围为3~950undefinedmicro;mol/mol,均在6min即完成了测定。A/Ci响应曲线结果如下图所示。
在红光下,生菜的最大羧化效率Vc,max为37.4undefinedmicro;mol/m2/s,蓝光下为27.4undefinedmicro;mol/m2/s低于红光下的最大羧化效率。这意味着在Rubisco的调节羧酸化活动中,红光的表现优于蓝光。最大电子传递速率(Jmax)蓝光下为47.3undefinedmicro;mol/m2/s,同样低于红光下的58.4undefinedmicro;mol/m2/s。磷酸丙糖使用(TPU)也具有同样的趋势(红蓝光下分别为4.16和3.30 undefinedmicro;mol/m2/s)。
根据McCree作用光谱,红光比蓝光具有更高的CO2固定量子产率。量子产率的差异与RubisCO、Jmax和TPU有关。叶绿素对蓝光的吸收效率反而要高于红光,这一现象使得红光可以到达叶片内部更深入的部位。并增强更深细胞层的电子传输,从而允许更多的细胞参与叶片二氧化碳固定。 此外,一些蓝光被类胡萝卜素和类黄酮吸收,这些类胡萝卜素和类黄酮将收获的能量转移到反应中心的效率低于叶绿素a和叶绿素b(Akimoto et al., 2005)。这导致在蓝光下Jmax进一步降低。 并且,一些卡尔文循环酶需要光来激活,深入的光渗透到叶片中可能因此有助于激活更多细胞中的卡尔文循环酶。在较深的细胞层中增强电子传递和卡尔文循环活性可以提高叶片的总光合能力。这与美国乔治亚大学园艺生理学实验室快速A/Ci曲线的结果一致。
引用文献:
|

 CIRAS4第四代便携式光合作用测定系统
CIRAS4第四代便携式光合作用测定系统
 FMS-300脉冲调制式荧光仪
FMS-300脉冲调制式荧光仪
 液相氧电极
液相氧电极
 CFLUX-1全自动土壤呼吸测定仪
CFLUX-1全自动土壤呼吸测定仪
 ——EGM-5 土壤碳通量快速测定
——EGM-5 土壤碳通量快速测定
 M-PEA 多功能植物效率分析仪
M-PEA 多功能植物效率分析仪
 TARGAS-1 便携式光合仪
TARGAS-1 便携式光合仪
 ——CFLUX-1全自动土壤呼吸测定仪
——CFLUX-1全自动土壤呼吸测定仪
 ——LSI-LASTEM气象监测系统
——LSI-LASTEM气象监测系统
 ——科研前线
——科研前线